警告・禁忌、使用上の注意
警告
本剤の投与により急性呼吸窮迫症候群があらわれ、死亡に至った例も報告されている。急速に進行する呼吸困難等の臨床症状に注意するとともに、胸部X線検査の実施等、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。〔「慎重投与」、「重要な基本的注意」、「重大な副作用」の項参照〕
(設定理由)
急性呼吸窮迫症候群(ARDS)については、本剤を投与した国内第Ⅱ相試験では認められませんでしたが、ユニタルクⓇと同じ原料を用いたSteritalcⓇの投与後に因果関係が否定できないARDSの発現例が海外で1例1)、及び国内で3例2,3)報告されており、いずれも死亡に至っているため記載しました。
禁忌
本剤又はタルクに対し過敏症の既往歴のある患者
(設定理由)
過敏症の発現は医薬品に対するアレルギー反応により発症すると考えられています。過敏症の既往歴のある患者への原因薬剤の投与は、より強い過敏症をひき起こすこともあるといわれていることから記載しました。
使用上の注意
1. 慎重投与(次の患者には慎重に投与すること)
(1)肺機能障害のある患者又は心機能障害のある患者〔呼吸不全等が発現するおそれがある。〕
(2)間質性肺疾患のある患者〔間質性肺疾患が増悪するおそれがある。〕
(設定理由)
(1)タルクにはまれですが、重篤な有害事象として急性呼吸窮迫症候群(ARDS)の発現が知られています。そのため、これら有害事象を予防、軽減するための対応措置をとることは重要であり、重症肺疾患(著明な肺線維症及び肺気腫等)の患者、心機能が著しく低下している患者に対して本剤を投与すると呼吸状態が悪化するおそれがあるため4,5)、本治療のベネフィットがリスクを上回ると判断される場合にのみ投与する等、当該症例への適応は慎重に判断すべきです。
(2)国内製造販売後に「間質性肺炎(間質性肺疾患)3例」、「間質性肺炎増悪3例」、「肺臓炎1例」が集積したため「重大な副作用」に「間質性肺疾患」に関する記載を追記致しました。更に、「間質性肺炎増悪3例」は合併症に間質性肺炎を有する患者で、本剤投与後に増悪が認められたため「慎重投与」に「間質性肺疾患のある患者」を追記し、注意喚起を行うこととなりました。
2. 重要な基本的注意
胸膜生検と同時又は直後に本剤を胸膜腔内に注入することは避けること。〔呼吸不全等が発現するおそれがある。〕
(設定理由)
タルクによる急性呼吸窮迫症候群(ARDS)発現機序として、小粒子径タルクの全身への移行に基づく炎症反応が考えられており6,7)、胸膜生検と同時又は直後にタルクの胸膜内投与を行うと、タルクの全身への移行が増加するおそれがあるため記載しました4,5,8)。
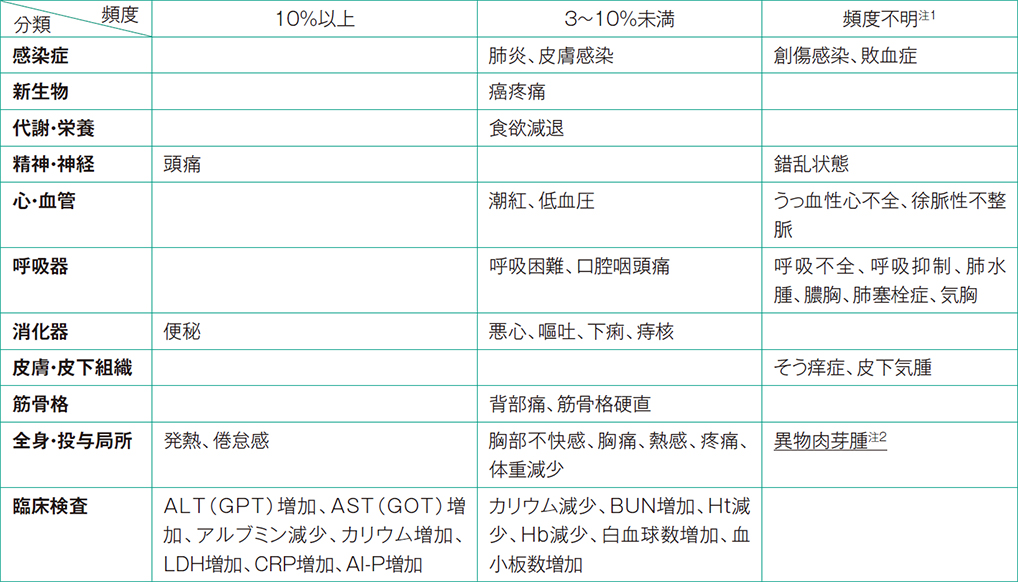
3. 副作用
悪性胸水が貯留した患者を対象とした国内第Ⅱ相試験9,10)において安全性を評価した30例中、副作用(臨床検査値異常を含む)発現症例は27例(90.0%)で、主な副作用は、CRP増加24例(80.0%)、発熱16例(53.3%)、ALT(GPT)増加5例(16.7%)、AST(GOT)増加4例(13.3%)、LDH増加4例(13.3%)、Al-P増加4例(13.3%)、便秘4例(13.3%)、倦怠感4例(13.3%)、頭痛3例(10.0%)、アルブミン減少3例(10.0%)、カリウム増加3例(10.0%)であった。(承認時)
(1)重大な副作用
| 1)急性呼吸窮迫症候群(頻度不明注1) | : | 急性呼吸窮迫症候群があらわれることがあるので、観察を十分に行い、急速に進行する呼吸困難、低酸素症、両側性びまん性肺浸潤影等の胸部X線異常等が認められた場合には適切な処置を行うこと。 |
|---|---|---|
| 2)間質性肺疾患(頻度不明注2) | : | 間質性肺疾患があらわれることがあるので、咳嗽、呼吸困難、発熱等の臨床症状を十分に観察し、異常が認められた場合には、胸部X線、胸部CT等の検査を実施すること。間質性肺疾患が疑われた場合には、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。 |
| 3)ショック、アナフィラキシー(頻度不明注2) | : | ショック、アナフィラキシーがあらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 |
(2)その他の副作用
次のような副作用があらわれた場合には、症状に応じて適切な処置を行うこと。
注1:国内外の公表論文に基づく副作用については頻度不明とした。
注2:自発報告において認められている副作用については頻度不明とした。
4. 妊婦、産婦、授乳婦等への投与
| (1) | 妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔妊娠中の投与に関する安全性は確立していない。〕 |
| (2) | 授乳中の婦人に投与する場合には授乳を中止させること。〔授乳中の投与に関する安全性は確立していない。〕 |
(設定理由)
下記の理由から妊婦、産婦、授乳婦等への投与に関する注意事項を記載しました。
| ① | ラットの妊娠6日にNPC-05(200、800mg/kg)を胸膜腔内に単回投与した際に、母動物、胚及び胎児に異常は認められませんでした11)が、妊婦及び授乳婦に対する本剤の安全性は確立していません。 |
| ② | 本剤と同じ原料を用いたSteritalcⓇの添付文書12)(適応症:「慢性胸膜炎、主に悪性」及び「自然気胸」など)においては、妊婦や授乳婦に対して禁忌となっています。 |
| ③ | 滅菌調整タルクである米国Bryan社製タルク製剤は米国胎児危険度分類カテゴリーBに分類されており、その添付文書13)(適応症:悪性胸水の再発抑制)では、「ウサギにヒト用量(1mg/m2)の約5倍の用量である900mg/kgのタルクを経口投与した生殖試験では、タルクに起因する催奇形作用の証拠は明らかにされなかった。しかし、妊婦における適切な、比較対照試験は行われていない。動物を用いた生殖試験では必ずしもヒトにおける反応が予測されるわけではないことから、有益性が危険性を上回らない限り本剤の妊婦への投与は行わないこと。」と記載されています。 |
5. 小児等への投与
小児等に対する安全性は確立していない。〔使用経験がない。〕
(設定理由)
本剤は小児に対する使用経験がなく、有効性及び安全性は確立しておらず、また米国Bryan社製タルク製剤の添付文書13)も参考に記載しました。
6. 過量投与
| (1) | 症状 |
| 10gを超えるタルクを投与した場合に、急性呼吸不全(急性呼吸窮迫症候群等)の発現率が高くなることが報告されている4)。 | |
| (2) | 処置 |
| 過剰に投与された本剤は日局生理食塩液による洗浄によって部分的に除去することが可能である。 |
(設定理由)
公表論文4)及び米国Bryan社製タルク製剤の添付文書13)を参考に記載しました。
| (1) | 症状 |
| タルク胸膜癒着術で発現する急性呼吸窮迫症候群(ARDS)は、タルクが肺もしくは胸膜の血管系に急速にかつ高濃度で侵入する疑いのある手技(胸膜擦過あるいは複数回の胸膜及び肺の生検)の実施、両側肺胸膜癒着術の同時施行、高用量タルク(10〜14g)の使用、又は患者の著明な肺機能低下(極めて重度の慢性閉塞性肺疾患又は縦隔もしくは肺への著明な腫瘍浸潤)のいずれかで発現するとし、急性呼吸窮迫症候群(ARDS)の原因の一つとしてタルクの過量投与(10gを超えるか、又は両側同時施行)を挙げています4)。 非臨床試験においても、ウサギにおいて、50mg/kg及び200mg/kgという2つの用量でタルクスラリー法*)による胸膜癒着術を実施した際の、胸膜外タルク堆積及びそれに関係する炎症反応を確かめるために無作為化比較試験が実施されました。その結果、高用量投与群でのみ対側肺、心臓、肝臓でのタルク堆積が認められ、また炎症反応も高用量投与群で強くみられています14)。 *:悪性胸水を胸腔ドレナージチューブにて排液後に、ユニタルクⓇを生理食塩液で懸濁して胸膜腔内に注入する方法。ユニタルクⓇの用法となります。 |
|
| (2) | 処置 |
| 米国Bryan社製タルク製剤の添付文書13)の記載「過剰に投与されたタルクは生理食塩水による洗浄によって部分的に除去することが可能である。」から引用しました。 |
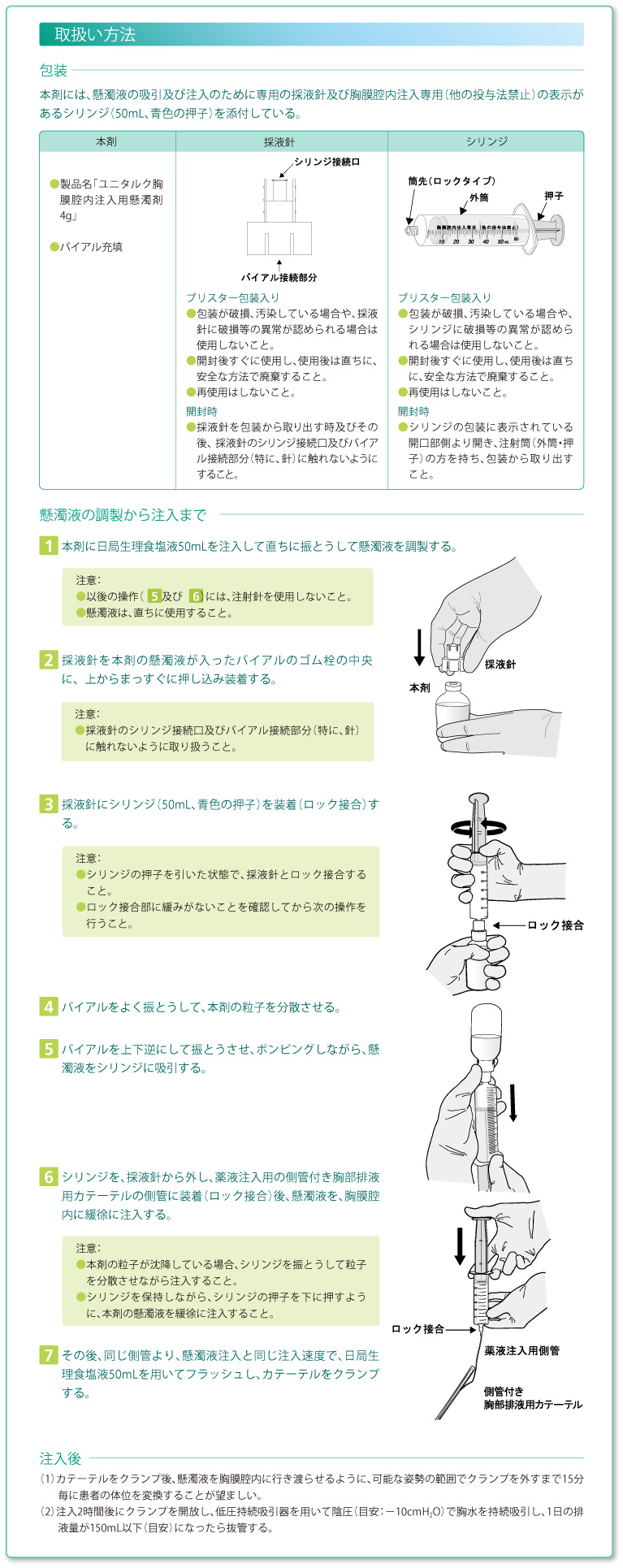
7. 適用上の注意
| (1) | 投与(注入)経路 |
| 本剤は胸膜腔内注入のみに使用し、他のいかなる注射経路(静脈内、筋肉内、皮下、皮内等)にも投与しないこと。 また、本剤を懸濁液としないで直接胸膜腔内に噴霧する方法では、使用しないこと。 |
|
| (2) | 調製方法 |
| 本剤の使用にあたっては、「取扱い方法」を熟読すること。 | |
| (3) | 投与(注入)方法 |
|
懸濁液の吸引及び注入には、添付の採液針及びシリンジを用いること。 1)注入前
|
(設定理由)
本剤の開発時に得られた情報並びにSteritalcⓇ12)及び米国Bryan社製タルク製剤13)の添付文書から記載しました。
| (1) | 本剤は胸膜癒着剤であるため、胸膜腔内にのみに使用し、他のいかなる注射経路に投与しないように注意喚起するために記載しました。なお、本剤の投与法はスラリー法のみである。 | ||||||
| (2) | 胸膜腔内以外への誤投与を防止するために、本剤には、懸濁液吸引及び注入のために専用の採液針及び胸膜腔内注入専用(他の投与法禁止)の表示があるシリンジ(50mL、青色の押子)を添付しており、それらを使用することについて記載しました。 「本剤の取り扱い方法」を参照ください。 |
||||||
| (3) |
|
8. その他の注意
コルチコステロイドを全身投与されている患者では、胸膜癒着が起こりにくいことが報告されている15)。
(設定理由)
タルクによる胸膜癒着は、タルク投与による壁側胸膜と臓側胸膜の炎症に引き続き起こる修復過程で生じるため、ステロイドをはじめとする抗炎症剤の併用で癒着効果が減弱する可能性があります16,17)。動物試験では、コルチコステロイドの併用で胸膜癒着術の有効性が低下する結果が得られており、ウサギを用いた試験では、タルク胸膜癒着術時のコルチコステロイド投与で胸膜の炎症反応が低下し、場合によっては胸膜癒着が阻止されることが示されています16)。臨床報告でもランダム化を伴わない経口コルチコステロイド使用の存在下及び非存在下で胸膜癒着術の有効性を比較したサブグループ分析でも、有効性に対するコルチコステロイドの悪影響が示唆されました17)。以上のことから記載しました。また、動物を用いた研究では、NSAIDの使用で胸膜癒着剤の作用が損なわれる可能性が示唆されていますが、臨床研究からの確証は得られていません18)。
参考:本剤の取扱い方法
- Kelly MG. Eur J Intern Med 2007; 18(8): 611
- 北川智余惠, 他. 肺癌 2007; 47: 462
- 龍華美咲, 他. 気管支学; 第34回日本呼吸器内視鏡学会学術集会抄録集 2011; 33: S210
- Sahn SA. J Bronchology 2002; 9(3): 223-7
- 奥村武弘. 肺癌(メジカルビュー社)2005: 132-5
- Maskell NA, et al. Am J Respir Crit Care Med 2004; 170: 377-82
- Noppen M. Eur Respir J 2007; 29: 619-21
- Janssen JP. Monaldi Arch Chest Dis 2004; 61(1): 35-8
- 社内資料: 悪性胸水に対する臨床試験
- Saka H, et al. Jpn J Clin Oncol. 2018; 48(4): 376-381
- 社内資料: ラットの生殖発生毒性試験
- SteritalcⓇ(仏国Novatech社製)の添付文書
- Sterile Talc PowerTM(米国Bryan社製)の添付文書
- Montes JF, et al. Am J Respir Crit Care Med 2003; 168: 348-55
- Roberts ME, et al. Thorax. 2010; 65(Suppl 2): ii32-ii40
- Xie C, et al. Am J Respir Crit Care Med 1998; 157: 1441-4
- Haddad FJ, et al. World J Surg 2004; 28(8): 749-54
- Hunt I, et al. Interact Cardiovasc Thorac Surg 2007; 6: 102-4