国内第Ⅱ相試験での安全性
(1)試験方法
| 目的 | 悪性胸水に対するNPC-05a)を用いた胸膜癒着術の有効性と安全性の検証 | |
|---|---|---|
| 試験デザイン | 非対照、非盲検、多施設共同臨床試験(6施設) | |
| 対象 | 組織診又は細胞診により確定診断した癌性胸膜炎を有する悪性胸水患者30例b) | |
| 投与方法 | NPC-05 4gを生理食塩液50mLに懸濁し、薬液注入用チューブから胸膜腔内に緩徐に注入(「治験薬を投与する前後の処置方法」を参照) | |
| 評価項目 | 主要評価項目 | 有効性判定委員会c)が評価した胸膜癒着術後30日(又は中止時)の胸水再貯留の有無 |
| 副次評価項目 |
|
|
| 解析計画 | 主要評価項目については、判定基準に基づく有効率を算出した。有効率の区間推定には、二項分布の正確な区間推定を用いた。観察された有効率に基づいて「真の有効率が、無効と判断する閾値有効率(40%)以下である」という帰無仮説の検定を二項分布を用いて行った。 | |
| a) | 国内第Ⅱ相試験(医師主導治験)はNovatech社(仏)より輸入した滅菌調整タルクであるSteritalcⓇをそのまま治験薬(NPC-05)として使用し、実施された。 なお、国内一貫製造のユニタルクⓇと治験薬NPC-05は品質に対する相対比較試験により同等であることが確認されている。 |
| b) | 解析対象:安全性解析対象集団(SP)及び最大の解析対象集団(FAS):30例 |
| c) | 有効性判定委員会:主要評価項目に規定した胸部X線写真を基に委員長及び委員が被験者情報をマスキングし、客観的に評価した。 |
評価項目の判定基準
- 胸水再貯留の有無:
- ドレイン抜管直後と胸膜癒着術後30日又は中止時の胸部X線を比較して判定した。
判定基準
有効:胸水の再貯留が認められない場合(抜管直後半胸郭の10%未満の貯留)
部分有効:胸水再貯留が抜管直後半胸郭の10%以上認められるものの、症状がない症例
無効:胸水再貯留が認められ有症状の場合
なお、『部分有効』は、無効例として取り扱った。
有効:胸水の再貯留が認められない場合(抜管直後半胸郭の10%未満の貯留)
部分有効:胸水再貯留が抜管直後半胸郭の10%以上認められるものの、症状がない症例
無効:胸水再貯留が認められ有症状の場合
なお、『部分有効』は、無効例として取り扱った。
- 呼吸困難・疼痛(胸痛)の程度:
- 胸水排液前と胸膜癒着術後30日又は中止時の呼吸困難・疼痛(胸痛)の程度を下表のグレードに従って判定した。
呼吸困難のグレード
グレード0:呼吸困難なし
グレード1:活動度高〜中
グレード2:活動度低
グレード3:寝たきり
グレード0:呼吸困難なし
グレード1:活動度高〜中
グレード2:活動度低
グレード3:寝たきり
疼痛(胸痛)のグレード
疼痛(胸痛)の程度は、Visual Analogue Scale(VAS)により評価した。100mmの直線の目盛りのないスケールにおいて、直線の左端は「痛みなし:0mm」、右端は「最大の痛み:100mm」とした。
疼痛(胸痛)の程度は、Visual Analogue Scale(VAS)により評価した。100mmの直線の目盛りのないスケールにおいて、直線の左端は「痛みなし:0mm」、右端は「最大の痛み:100mm」とした。
治験薬を投与する前後の処置方法
| 胸水の排液 | 16〜24Fのダブルルーメン胸腔ドレナージチューブを胸腔に留置して1,000mL/日以下の速度を目安に排液し、排液量が1,000mL/日を超える場合は2日以上かけて可能な限り排液した。排液後、胸部X線写真で肺が再膨張し、呼吸困難等の症状の緩和が得られることを確認した。 | |
|---|---|---|
| 胸膜癒着術 | 調製方法 | NPC-05 4gを生理食塩液50mLに懸濁した。なお、胸水排液後に肺が再膨張し、呼吸困難等の症状が緩和することを確認した後に懸濁液を調製した。 |
| 前処置 | NPC-05懸濁液の注入前に、疼痛(胸痛)を抑えるため、1%塩酸リドカイン10mLを薬液注入用チューブから胸膜腔内に注入した。 | |
| 治験薬投与 | NPC-05懸濁液をシリンジに採り、薬液注入用チューブから胸膜腔内に緩徐に注入した。その後、胸膜腔内に十分に行き渡るように、生理食塩液50mLを同様に追加注入して、ドレナージチューブをクランプした。 | |
| 胸膜癒着術及び術後胸水の排液 | NPC-05懸濁液を胸膜腔内に行き渡るように、可能な姿勢の範囲で15分毎に体位変換した。注入2時間後、クランプを開放してNPC-05懸濁液を排液した。排液は低圧持続吸引器を用いて陰圧(目安:-10cmH2O)で持続吸引し、1日の排液量が150mL以下になった時点で抜管した。術後7日間で排液量が150mL以下にならない場合は、無効例として治験を中止した。 | |
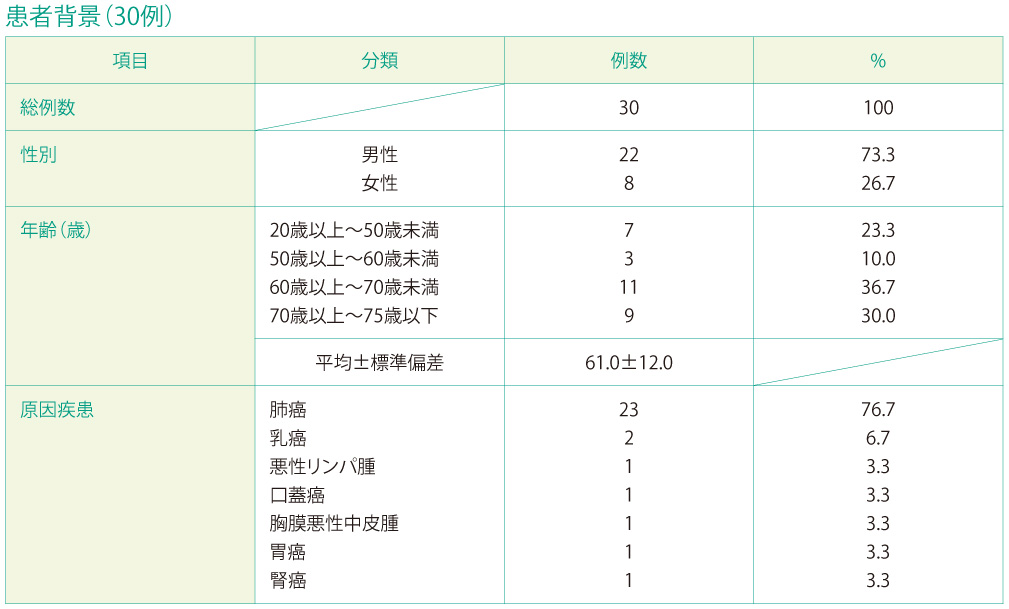
(2)患者背景
性別は、男性が22例(73.3%)、女性が8例(26.7%)で男性患者が多く、悪性胸水の原疾患としては、肺癌が76.7%(23/30例)でした。
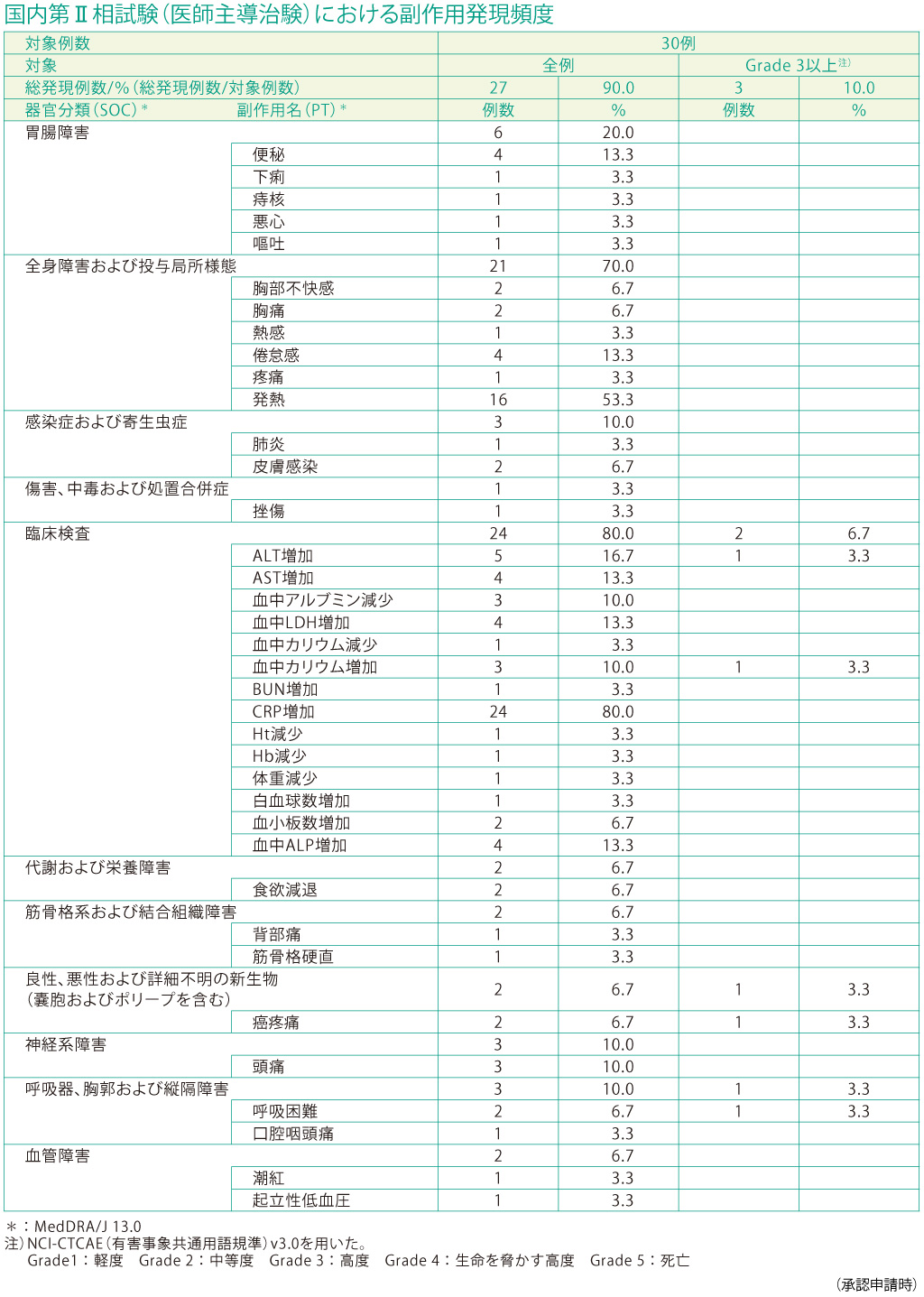
(3)安全性
副作用(臨床検査値異常を含む)の発現は、30例中27例(90.0%)に認められました。主な副作用は、CRP増加24例(80.0%)、発熱16例(53.3%)、ALT(GPT)増加5例(16.7%)、AST(GOT)増加4例(13.3%)、LDH増加4例(13.3%)、Al-P増加4例(13.3%)、便秘4例(13.3%)、倦怠感4例(13.3%)、頭痛3例(10.0%)、アルブミン減少3例(10.0%)、カリウム増加3例(10.0%)でした。(承認時)
副作用の重症度別では、高度が10%(3/30例)、中等度が46.7%(14/30例)、軽度が90%(27/30例)であり、生命を脅かす高度な副作用は認められませんでした。投与後の期間別では、投与後1〜7日までの発現率は86.7%(26/30 例)で、それ以降は30%以下に低下しました。特に、発熱及びCRP増加は投与後1〜7日に集中して発現しました。本臨床試験では、急性呼吸窮迫症候群(ARDS)は発現せず、重篤な副作用、治験中止に至った副作用は報告されませんでした。本試験終了後死亡例が3例みられましたが、試験との因果関係は否定されました。
- 社内資料: 悪性胸水に対する臨床試験
- Saka H, et al. Jpn J Clin Oncol. 2018; 48(4): 376-381
